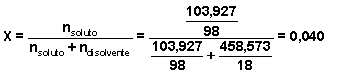LAS DISOLUCIONES
RESOLUCIÓN del problema nš 29
Se dispone de tres disoluciones de ácido sulfúrico:
A: 1,686 M y d = 1,1000 g/ml;
B: 2, 559 M y d = 1,1500 g/ml y
C: 27,72 % y d = 1,2000 g/ml .
- Se toman 200 ml de A, 150 ml de B y 100 ml de C y se lleva finalmente a un volumen de 500 ml con lo que se obtiene una disolución de d = 1,1250. - Expresar las concentraciones de las disoluciones A, B y C y de la disolución final en N, M, m y % en peso.(Sol.: 2,12 Molar ; 4,24 Normal ; 2,31 molal y del 18,47% en peso)
Disolución A: Los gramos de disolución se calculas a partir de la densidad y el volumen, ambos conocidos, mientras que la cantidad de soluto se determina a partir de la Molaridad de la disolución, mientras que la cantidad de disolvente es la diferencia entre el total y la cantidad de soluto:
| Soluto | Disolvente | Disolución |
| 33,046 g. | 186,954 g | 220,000 g. |
| 0,200 litros |
![]()
![]()
g disolvente = g disolución - g soluto = 220,000 - 33,046 = 186,954 g disolvente
Disolución B: Los cálculos se realizan de la misma forma que en el caso de la disolución A
| Soluto | Disolvente | Disolución |
| 37,617 g. | 134,883 g | 172,500 g. |
| 0,150 litros |
![]()
![]()
g disolvente = g disolución - g soluto = 172,500 - 37,617 = 134,883 g disolvente
| Soluto | Disolvente | Disolución |
| 33,264 g. | 86,736 g | 120,000 g. |
| 0,100 litros |
![]()
y el 27,72% de esos 120,000 g serán de soluto:
![]()
g disolvente = g disolución - g soluto = 120,000 - 33,264 = 86,736 g disolvente
Al mezclar las tres disoluciones y añadirle más agua, la cantidad total de soluto será la suma de las cantidades añadidas con las tres disoluciones = ( 33,046 + 37,617 + 33,264) = 103,927 g de soluto.
El volumen de la disolución es de 500 ml, y la masa total se obtiene a partir de la densidad de esta disolución final, siendo la cantidad de disolvente la diferencia entre la cantidad de disolución y la de soluto:
![]()
g disolvente = g disolución - g soluto = 562,500 - 103,927 = 458,573 g disolvente
y con todos estos datos, rellenamos el cuadro general
| Soluto | Disolvente | Disolución |
| 103,927 g. | 458,573 g | 562,500 g. |
| 0,500 litros |
g/litro = 103,927 / 0,5001 = 207,854 g/litro
% en peso = 103,927 x 100 / 562,500 = 18,48 %
- p.p.m. : 103927 mg soluto / 0,5625 Kg disolución = 184759,11 p.p.m
MOLARIDAD: ![]()
NORMALIDAD: N = M x v = 2,121 x 2 = 4,242 Normal
molalidad: ![]()
FRACCIÓN MOLAR: