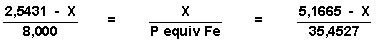
CONCEPTOS GENERALES DE QUÍMICA:
RESOLUCIÓN del problema nº 44
Suponemos que se tienen "x" gramos de Fe, por lo que en el óxido el resto será oxígeno en el óxido y cloro en el cloruro. Así:
- gramos de oxígeno en el óxido: ( 2,5431 - x ) g de oxígeno
- gramos de cloro en el cloruro: ( 5,1665 - x ) g de cloro.
Teniendo en cuenta, además, que
A) en el óxido en número de equivalentes de Hierro ha de ser igual al número de equivalentes de oxígeno
en el cloruro, el número de equivalentes de hierro ha de ser igual al número de equivalentes de cloro
Tanto la cantidad de hierro como su valencia son las mismas en el óxido que en el cloruro
resultará que: Nº equivalentes de O = Nº equivalentes de Fe = Nº de equivalentes de Cl
y el número de equivalentes de cada elemento se obtiene al dividir la masa de ese elemento entre su peso equivalente, y que este peso equivalente se conoce para el oxígeno ( 8,0000 g/equivalente) y en el caso del cloro nos indica el enunciado del problema que el peso equivalente coincide con el peso atómico, será, para éste: 35,4527 g/equivalente, de donde:
Nº equivalentes de O = Nº equivalentes de Fe = Nº de equivalentes de Cl
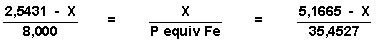
Igualando el número de equivalentes del Fe a los de Cloro:
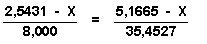
Donde al despejar nos queda: X = 1,7786 g de hierro en ambos compuestos
de esta forma: g de O en el óxido = 2,5431 - 1,7786 = 0,7645 g =>
(0,7645/8,0000 ) = 0,09556 equivalentes de O
y en el cloruro : gramos de cloro = 5,1665 - 1,7786 = 3,3879 g =>
(3,3879 / 35,4527 ) = 0,09556 equivalentes de Cl
y este número de equivalentes será también el de hierro en ambos compuestos, así
Nº equiv. de Fe = (gramos de Fe) / (Peso equivalente del Fe) 0,09556 = 1,7786 / P equiv del Fe
y de ahí: Peso equivalente del Fe = 18,6124 g/equivalente