CONCEPTOS GENERALES DE QUÍMICA:
RESOLUCIÓN del problema nº 48
Al quemarse el compuesto, todo el C irá a parar al dióxido de carbono y todo el H irá al agua, por lo que las cantidades de ambos elementos pueden determinarse directamente, pero el O que contenía el compuesto se repartirá entre ambos, junto con el O del aire necesario para la combustión, por lo que la cantidad de oxígeno se determinará por diferencia entre la cantidad inicial de muestra y las cantidades de C e H.![]()
![]()
por lo que la cantidad de O que había en la cantidad inicial del compuesto orgánico es:
7,49 - 4,08 - 0,68 = 2,73 g de O
Teniendo en cuenta estas cantidades, determinamos el número de átomos gramo de cada elemento que hay en estas cantidades

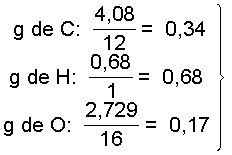 por lo que la fórmula empírica es:
(C2H4O)x
por lo que la fórmula empírica es:
(C2H4O)x
Para determinar su fórmula molecular, se sabe que su peso molecular es 176, por lo que:
176 = x.(2.12 + 4.1 + 1.16) ; x = 4 y así, la fórmula molecular es: C 8 H 16 O 4