Grupo B - LEYES GENERALES DE LOS GASES IDEALES:1,2,3,4,5,6,7
A-1 - Un vapor es:
A - Cualquier gas puede llamarse también así.
B - Solamente puede aplicarse este nombre a la fase gaseosa de cualquier sustancia que generalmente se presenta en estado líquido.
C - Solamente se llama así la fase gaseosa del agua, recibiendo el nombre de "vapor de agua"
D - Este nombre es aplicable a la fase gaseosa de cualquier sustancia que en las condiciones ambientales no se encuentre en estado de gas.
A - No existe diferencia alguna, y pueden utilizarse indistintamente ambos conceptos.
B - El concepto de vapor se utiliza para definir la fase gaseosa de cualquier sustancia que generalmente se encuentra sólida o líquida .
C - El concepto de gas solamente se aplica a los gases ideales, debiendo emplearse el concepto de vapor para las demás sustancias no ideales.
D - El concepto de vapor se aplica exclusivamente para nombrar la fase gaseosa del agua, debiendo emplearse el de gas para las demás sustancias .
B - Es cualquier gas tal que para un mol del mismo se cumpla la ecuación: (P.V)/(R.T) = 1
C - Cualquier gas noble es un gas ideal.
D - Cualquier gas al que se le puedan aplicar las ecuaciones generales de los gases a presiones bajas.
B - Unas condiciones arbitrarias estandarizadas que nos permiten agilizar los cálculos.
C - Aquellas en las que un mol ocupa un volumen previamente establecido cuyo valor es universal, pues es una constante.
D - Unas condiciones de referencia arbitrarias, que nos permiten efectuar comparaciones entre diversas muestras gaseosas así como en ciertas ocasiones agilizar los cálculos sencillos
A - Todos los gases medidos en las mismas condiciones de presión y temperatura, ocupan el mismo volumen.
B - Muestras de gases medidas en las mismas condiciones de presión y temperatura contienen el mismo número de moléculas
C - El número de moléculas contenido en dos volúmenes iguales de gases es siempre el mismo.
D - Volúmenes iguales de gases medidos en las mismas condiciones de presión y temperatura contienen el mismo número de moléculas
A - 22,4 litros es el volumen que ocupa una muestra de gas en condiciones normales.
B - Medio mol de cualquier gas a 273K y 760 mm Hg de presión ocupa 11,2 litros.
C - 16 g. de oxígeno en condiciones normales ocupan el mismo volumen que 16 g. de ozono en las mismas condiciones.
D - Un mol de aluminio ocupa 22,4 litros si lo medimos en condiciones normales.
B - Para todos los gases es siempre menor que la composición porcentual en peso.
C - Es también igual que su composición porcentual en moles.
D - Es intermedia entre el valor correspondiente a su proporción en peso y la correspondiente proporción porcentual en moles.
A - Para cualquier sustancia, el producto de la presión por el volumen que ocupa es constante, si no varía su temperatura.
B - El producto de la presión por el volumen que ocupa una determinada cantidad de cualquier gas es siempre constante, si no varía la temperatura.
C - A presión constante, el cociente entre el volumen que ocupa una determinada cantidad de gas y la temperatura absoluta a la que se encuentre, es constante.
D - Para cualquier gas ideal, el producto de la presión por el volumen que ocupe, dividido por la temperatura absoluta a la que se encuentre, es siempre constante.
A - Estudia la relación entre las presiones y las temperaturas de una muestra concreta de gas.
B - Encuentra la relación entre los volúmenes de una misma masa de gas a dos temperaturas distintas cuando la presión permanece constante.
C - La expresión matemática de dicha ley cuando la masa, y la presión del gas son constantes, podría ser la
siguiente: 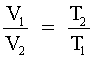
D - Indica que en condiciones normales, el volumen de una sustancia, si aún permanece en estado gaseoso, podrá deducirse a partir de sus condiciones previas.
A - TN2 = TO2 = TCO
B - TN2 = TCO > T02
C - TN2 = TCO < T02
D - TO2 > TCO > TN2
B - Es la presión que ejerce un gas componente de una mezcla cuando se encuentra él solo ocupando el volumen total en las mismas condiciones de presión y temperatura que la mezcla de la que forma parte.
C - Es la presión que ejerce cada mol de gas en una mezcla de gases que se encuentran en un determinado recipiente.
D - Es la presión que ejercería un gas que forme parte de un compuesto si ocupara él solo el volumen total.
B - La presión parcial de un gas componente de una mezcla es igual al producto de la presión que ejerce dicha mezcla de gases por la fracción molar de dicho gas.
C - Si dos elementos químicos gaseosos se combinan para formar distintos compuestos y la cantidad de uno de ellos permanece fija, las cantidades del otro que se combinan con él están en una relación numérica sencilla.
D - La presión total que ejerce una mezcla de gases es igual a la suma de las presiones parciales de todos sus componentes.
A - 6
B - El mismo ya que en ambos casos se trata de gases diatómicos en iguales condiciones de presión y temperatura
C - 24
D - 48
A - El volumen ocupado por el gas.
B - La presión total del recipiente.
C - La cantidad del gas en el recipiente.
D - Ninguna de las respuestas anteriores es cierta.
Grupo B: Leyes generales de los gases: 1-B, 2-B, 3-C, 4-A, 5-D, 6-C, 7-C