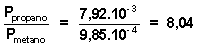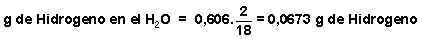
LOS GASES
RESOLUCIÓN del problema nº 19:
Se tiene una corriente de gas formada por una mezcla de metano (CH4) y propano (C3H8) y queremos conocer las presiones relativas de los dos gases por lo que quemamos la mezcla en un exceso de Oxígeno y recogemos dióxido de carbono y agua.- ¿Cual es la relación entre las presiones si encontramos 1,09 g. de dióxido de carbono por cada 0,606 g. de agua? (Sol: P propano/P metano = 8,04)
RESOLUCIÓN
En ambos hidrocarburos hay exclusivamente C e H, los cuales, al quemarse, originan CO 2 y H 2 O, por lo que la cantidad de carbono que haya en los 1,09 g de CO 2 proviene de la suma del carbono existente en el metano y en el propano, mientras que el hidrógeno existente en los 0,606 g de agua procederá también de ambos.
Así, vamos a calcular la cantidad de Carbono existente en el CO 2 y la de Hidrógeno existente en el H 2 O:
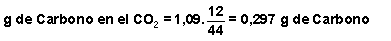
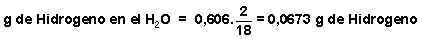
Si suponemos que en la corriente de gas existen "x" moles de metano por cada "y" moles de propano, las cantidades de C e H en cada uno de los dos gases son:
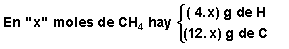
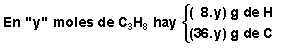
por lo que tendremos: 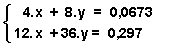 y al resolver este sistema obtenemos el número de moles de
ambos hidrocarburos: para el metano: n metano = x = 9,85.10 - 4 moles
y para el propano: n propano = y = 7,92.10 - 3
y al resolver este sistema obtenemos el número de moles de
ambos hidrocarburos: para el metano: n metano = x = 9,85.10 - 4 moles
y para el propano: n propano = y = 7,92.10 - 3
La relación entre las presiones parciales de ambos las sacamos aplicándole a ambos la ecuación general de los
gases ideales: P propano . V total = n propano .R.T
Y para el metano: P metano . V total = n metano .R.T y si
dividimos miembro a miembro ambas, nos queda: 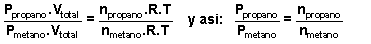 Por tanto :
Por tanto :