CELDA o CÉLULA ELECTROLÍTICA: Contrariamente a las reacciones redox
espontáneas que convierten la energía química en energía eléctrica, la electrolisis es el proceso en
el cual la energía eléctrica se usa para provocar una reacción química no espontánea, proceso que
se realiza en las celdas electrolíticas o celdas de electrolisis.
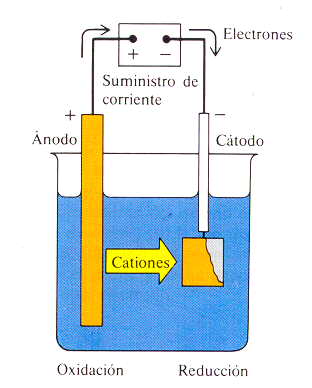
| Una celda electrolítica sencilla como la de la figura vemos
que tiene una construcción similar a la de las pilas
electroquímicas: dos electrodos sumergidos en una
disolución, aunque en este caso el funcionamiento es
completamente distinto, ya que en este caso se le
suministra corriente eléctrica a la célula electrolítica al
conectar sus electrodos a una fuente externa, y esta
corriente eléctrica es la que va a provocar la reacción
química en su interior.
Si esta célula contiene, por ejemplo, NaCl fundido, los electrones entran en ella a través del cátodo
provocando la reducción de los cationes: Na + + 1 e - --> Naš y este sodio se retira de la célula por
distintos procedimientos, según el sistema elegido.
|
 |
Los electrones se eliminan de la célula por el ánodo, que es el electrodo en el cual se produce la
oxidación de los iones cloruro: 2 Cl --> Cl 2 ( g ) + 2 e - y este cloro gaseoso se retira también de la
célula.
Estas células electrolíticas pueden emplearse, además de para obtener elementos, para purificarlos.
Así, si tenemos una célula con una disolución de iones Cobre (Cu 2 +) y situamos un ánodo de cobre
con impurezas, los electrones entran en la celda por el cátodo, reduciendo a los iones cobre:
Cu 2 + + 2 e - --> Cuš, el cual se deposita en el cátodo, el cual no tiene por qué ser de cobre, mientras
qie esos mismos electrones se eliminan por el ánodo, en el cual se produce la oxidación del cobre:
Cuš -> Cu 2 ++ 2 e - el cual pasa a la disolución. De esta forma vamos consiguiendo que el ánodo de cobre con
impurezas vayan pasando a la disolución y, desde allí, se depositan sobre el cátodo, ya exentos de
impurezas.
