ESCUELA TÉCNICA SUPERIOR DE INGENIEROS INDUSTRIALES - UNED
Química I - Junio 2002 - 1ª semana
CUESTIÓN 4
-Se tiene una disolución de dicromato potásico al 1%, cuya densidad relativa es prácticamente la unidad. Calcular el volumen de ésta necesario para preparar 250 mL de una disolución 0,1 N de dicromato potásico para actuar como oxidante, sabiendo que el dicromato solo actúa en medio ácido y pasa a sal crómica
RESOLUCIÓN
La reacción iónica de reducción del ion dicromato cuando actúa como oxidante es:
Cr 2 O 7 2 - + 14 H + + 6 e - --> 2 Cr 3 + + 7 H 2 O , por lo que la "valencia" es 6 (nº de electrones intercambiados).
Para determinar los gramos de dicromato de potasio (K 2 Cr 2 O 7 Pm =294,2) se parte de la fórmula que nos da el valor de la normalidad de una disolución:
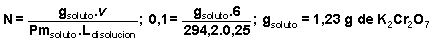
Estos 1,22 g de dicromato de potasio hemos de tomarlos de esa disolución que tiene un 1% de dicho reactivo,,por lo que hemos de tomar 100.1,23= 123 gramos de la disolución pero dado que también nos indican que su densidad es prácticamente 1 g/ml, la cantidad en ml de la misma será también 123 ml de esa disolución los necesarios