1 - CONCEPTO DE DISOLUCIÓN.
Como ya hemos indicado, la materia se puede clasificar teniendo en cuenta diferentes propiedades, así es homogénea o heterogénea, según que su composición y propiedades sean idénticas en las distintas partes de la misma o bien sean diferentes. También puede clasificarse como sustancia pura o mezcla, según que tenga un solo componente o tenga varios.
Pues bien, cuando se tiene una mezcla homogénea, se le llama DISOLUCIÓN.
Una disolución está formada por varios componentes: DISOLVENTE Y SOLUTOS.
El DISOLVENTE es el componente mayoritario de la disolución. No obstante, si uno de los componentes es el agua se la suele considerar como disolvente aunque no sea el componente que se encuentre en mayor proporción. También puede tomarse como disolvente, en ocasiones, aquel componente que se encuentra en el mismo estado físico que la disolución. Por tanto, en una disolución solamente hay un disolvente.
Los SOLUTOS son todos los demás componentes de la disolución.
Las disoluciones podemos distribuirlas en varios grupos, según la propiedad que utilicemos para clasificarlas: así, si nos fijamos en el estado físico del soluto y del disolvente, tendremos
Las DISOLUCIONES VERDADERAS son claras, las partículas de soluto son invisibles, atraviesan tanto los filtros ordinarios como las membranas y no precipitan cuando se dejan en reposo.
Las DISOLUCIONES COLOIDALES o COLOIDES son claras, las partículas del soluto son visibles únicamente con ultramicroscopios, con los cuales puede verse el movimiento de las partículas del soluto: caótico, incesante y describiendo trayectorias irregulares en zig-zag (movimiento browniano). Estas partículas atraviesan los filtros ordinarios pero no las membranas y si se dejan en reposo no precipitan. Cuando son atravesadas por un rayo de luz, su trayectoria en el seno de la disolución se hace visible mediante pequeños puntos luminosos (Efecto Tyndall) Las partículas coloidales, llamadas micelas, pueden estar constituidas por moléculas o iones, normalmente poseen carga eléctrica y son de mayor tamaño que las moléculas átomos o iones de la fase dispersante. Tanto la fase dispersante (disolvente) como la fase dispersa (soluto) pueden ser sólidos, líquidos o gases, aunque nunca pueden ser ambos gases
|
Fase del coloide |
Sustancia dispersante (Disolvente) |
Sustancia dispersa (Soluto) |
Tipo de coloide |
Ejemplo |
|
Gaseosa Gaseosa Líquida Líquida Líquida Sólida Sólida Sólida |
Gaseosa Gaseosa Líquida Líquida Líquida Sólida Sólida Sólida |
Líquida Sólida Gaseosa Líquida Sólida Gaseosa Líquida Sólida |
Aerosol Aerosol Espuma Emulsión Sol Espuma sólida Emulsión sólida sol sólido |
Niebla Humo Crema batida Leche Pintura Malvavisco Mantequilla Vidrio coloreado |
Pero si nos interesa la proporción relativa en que se encuentran el soluto y el disolvente, las disoluciones nos quedarán clasificadas de la forma siguiente:
EXPRESIONES CUALITATIVAS son aquellas en las que se indica la proporción relativa entre el soluto y disolvente de una manera aproximada, donde, a su vez, pueden clasificarse atendiendo a dos propiedades diferentes:
a) Comparando la cantidad de soluto con la cantidad de disolvente, las disoluciones pueden ser:
DISOLUCIONES CONCENTRADAS: son aquellas en las que la cantidad de soluto es grande comparada con la de disolvente,
DISOLUCIONES DILUIDAS: son aquellas en las que la cantidad de soluto es pequeña con relación a la cantidad de disolvente.
b) Comparando la cantidad de soluto que contiene con la máxima cantidad que puede contener esa cantidad de disolvente, podemos clasificar las disoluciones en:
DISOLUCIONES INSATURADAS: Son aquellas que contienen menos cantidad de soluto de la cantidad máxima que pueden contener.
DISOLUCIONES SATURADAS: Son aquellas que contienen la máxima cantidad de soluto que admite el disolvente
DISOLUCIONES SOBRESATURADAS: Son aquellas que contienen más cantidad de soluto de la máxima cantidad que pueden contener. Son disoluciones inestables en las que cualquier modificación de las condiciones hace que precipite la cantidad de soluto en exceso.
EXPRESIONES CUANTITATIVAS son aquellas en las que se indica exactamente las cantidades de soluto y disolvente. Pueden expresarse en unidades físicas (en general utilizando unidades de masa o volumen: gramos, litros, ...) o bien en unidades químicas (moles o equivalentes químicos).
3 - CALCULO DE LA CONCENTRACIÓN DE LAS DISOLUCIONES
Entre las expresiones de la concentración que utilizan unidades físicas para la medida de la masa (gramos o Kilogramos) que más se utilizan tenemos:
A) GRAMOS POR LITRO en la que se expresa el número de gramos de soluto que hay por cada litro de disolución.
Cuando se trata de disoluciones diluidas, el volumen de la disolución coincide casi exactamente con el volumen de disolvente, pero no sucede así cuando se trata de disoluciones concentradas.
B) % EN PESO DE SOLUTO: en el que se indican los gramos de soluto que hay por cada 100 gramos de disolución.
La masa total de la disolución se determina sumando la masa del soluto y la de la disolvente.
D) MOLARIDAD, que es el número de moles de soluto que hay en 1 litro de disolución. ( (1) )
a) Calcular la concentración de la sustancia disuelta suponiendo que no se hubiera disociado, tal como se hace normalmente; a esta expresión algunos autores la denominan Formalidad o Formularidad debido a que se toma como peso molecular el resultante de la fórmula del compuesto de que se trate.
b) Admitir el hecho de la disociación total del soluto y calcular separadamente la concentración molar de cada uno de los
iones procedentes de la disociación del compuesto inicial.
E) NORMALIDAD, que es el número de equivalentes químicos de soluto que hay en 1 litro de disolución.
El equivalente químico, equivalente gramo o peso equivalente es la cantidad de una sustancia que reacciona o sustituye exactamente a 1 átomo gramo de hidrógeno (1,008 gramos) o a medio átomo gramo de oxígeno (8,000 g). Para calcularlo se divide el peso atómico (o molecular si se trata de un compuesto) entre su valencia. La valencia en el caso de un elemento, es su número de oxidación, pero en un compuesto hemos de tener en cuenta el tipo de compuesto de que se trata, así podemos tener:
- ÁCIDOS, en los que su valencia es el número de H que tiene la molécula: HCl =>1 ; H2SO4 =>2
- BASES, que son los hidróxidos, en los que su valencia es el número de OH presentes en su molécula: NaOH =>1 ; Ca(OH)2 =>2
- SALES: en ellas, la valencia corresponde al número de H sustituidos (los que había en el ácido y que han sido sustituidos por metales para formar la sal): NaCl => 1 ; CaCO3 =>2
- REACCIONES REDOX: en ellas la "valencia" corresponde al número de electrones intercambiados en dicha reacción: Así, las "valencias en las reacciones siguientes son:
Fe 2+ --->Fe 3+ + 1e -, la "valencia" es 1,
MnO4- + 8 H+ + 5 e- ---> Mn2+ + 4 H2O ; la "valencia" es 5.
Y así, nos quedará:
Como la masa, en gramos, de cada mol de soluto nos la da su peso molecular (o masa molecular media):
F) MOLALIDAD, que es el número de moles de soluto que hay por cada Kg de disolvente.
Como la masa, en gramos, de cada mol de soluto nos la da su peso molecular:
Como podemos ver todas estas expresiones nos presentan una relación entre la cantidad de soluto y las de disolución o disolvente, según los casos expresando las cantidades relativas en unidades de masa o de volumen, según el caso. Por ello, hemos de buscar la relación entre las cantidades de soluto, disolvente y disolución, expresadas como masa y como volumen. para ello, vamos a utilizar un cuadro en el cual indicaremos estas cantidades:
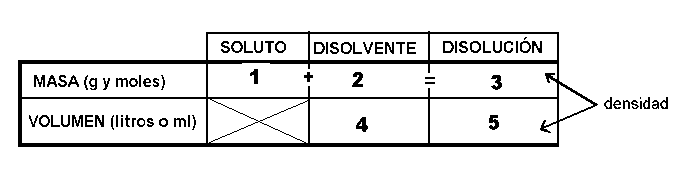
en el recuadro 1, escribiremos la cantidad de soluto, expresada en gramos y/o moles; en el recuadro 2, la cantidad de disolvente, expresada también como gramos y/o moles y en el recuadro 3, la cantidad de disolución, expresada también como gramos y/o moles; la cantidad que aparece en este cuadro es la correspondiente a la suma de las cantidades que aparecen en los recuadros 1 y 2, ya que las masas son siempre aditivas. En el recuadro 5 se escribe el volumen total de la disolución, expresada en litros y/o ml. Esta cantidad se relaciona con la indicada en el recuadro 3 (ambos se refieren a la disolución) por medio de la densidad de la disolución, ya que la densidad es la relación entre la masa y el volumen de un cuerpo. Si se trata de disoluciones muy diluidas, se puede suponer sin que ello represente un error apreciable, que el volumen de la disolución coincide prácticamente con el volumen del disolvente, por lo que , en este caso, las cantidades que aparecen en los recuadros 4 y 5 son las mismas. De esta forma, podemos relacionar también las cantidades que aparecen en los recuadros 2 y 4 ya que al referirse ambos al disolvente, la densidad del mismo nos los relaciona. Cuando el disolvente sea el agua, cuya densidad es prácticamente 1 g/ml, las cantidades que aparecen en el recuadro 4 (expresada en ml) es numéricamente igual a la que aparece en el recuadro 2 ( expresada 10 g)
CALCULO DE LA CONCENTRACIÓN EN LAS MEZCLAS DE VARIAS DISOLUCIONES
Cuando se prepara una disolución mezclando otras varias, hemos de tener en cuenta que se va a obtener una nueva disolución en la cual la cantidad de soluto será la suma de las cantidades añadidas con cada una de las disoluciones que se mezclaron y análogamente sucederá con la cantidad de disolvente.
Para simplificar estos cálculos vamos a utilizar un cuadro similar al empleado para una sola disolución, en el cual vamos a indicar las cantidades de soluto y disolvente de todas las disoluciones a mezclar.
| SOLUTO | DISOLVENTE | DISOLUCIÓN | |||
| Masa 1 |
gramos y/o moles |
+ | gramos, moles y/o Kg | = | gramos |
| Masa 2 | gramos y/o moles | + | gramos, moles y/o Kg | = | gramos |
| Masa 3 | gramos y/o moles | + | gramos, moles y/o Kg | = | gramos |
| Masa total | gramos y/o moles | + | gramos, moles y/o Kg | = | gramos |
| Volumen 1 | ------ | litros y/o mililitros | |||
| Volumen 2 | ------ | litros y/o mililitros | |||
| Volumen 3 | ------ | litros y/o mililitros | |||
| Volumen total | ------ |
litros y/o mililitros |
En cuanto a los volúmenes, no podemos afirmar lo mismo ya que en la mayor parte de las ocasiones los volúmenes no son aditivos, sin embargo, la relación entre el volumen y la masa de cada disolución están relacionados por la densidad de la misma.