PROBLEMAS Y EJERCICIOS DE
APLICACIÓN DE LAS LEYES GENERALES DE LOS GASES
EJERCICIOS RESUELTOS
1) Se tienen 6 litros de aire a una presión de 720 mm Hg y una temperatura de 0ºC. Determinar el volumen que
ocuparán si se triplica la presión y la temperatura aumenta 67ºC.
SOLUCIÓN:
Antes de realizar cálculo alguno debemos transformar los datos correspondientes a las condiciones iniciales y
finales del gas para expresar la presión en atmósferas, la temperatura en ºK y el volumen en litros:
|
CONDICIONES INICIALES |
CONDICIONES FINALES |
Presión: Pi =  0,947 atm 0,947 atm
Temperatura: Ti =
0ºC = 273 ºK
Volumen: V i = 6 litros |
P f = 3 . 0,947 = 2,842 atm
Tf = 67ºC = 340 ºK
V f = ? |
Y ahora , se le aplica la ecuación general de los gases ideales:
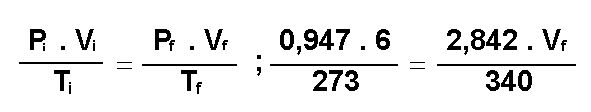 de donde:
de donde:  ;
V f = 2,490 litros
;
V f = 2,490 litros
2) Se tienen 150 cm3 de un gas a 42ºC y 714 mm Hg. Determina la temperatura a la que deberán encontrarse para
ocupar 102 cm3 a una presión de 830 mm Hg
SOLUCIÓN
Para poder aplicarle la ecuación general de los gases ideales debemos transformar los datos correspondientes a
las condiciones iniciales y finales del gas para expresar la presión en atmósferas, la temperatura en ºK y el volumen
en litros:
|
CONDICIONES INICIALES |
CONDICIONES FINALES |
Presión: Pi = 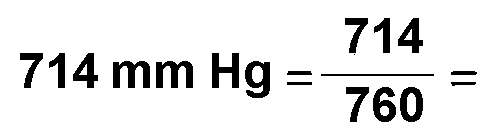 0,939 atm 0,939 atm
Volumen: V i = 150 cm3 = 0,15 litros
Temperatura: Ti =
42ºC = 315 ºK |
P f =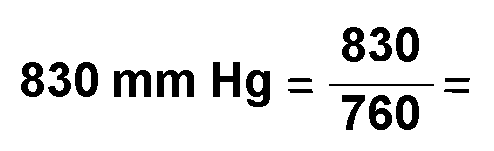 1,092 atm 1,092 atm
V f = 102 cm3 = 0,102 litros
Tf = ? ºK |
Y al aplicarle la ecuación general de los gases ideales:
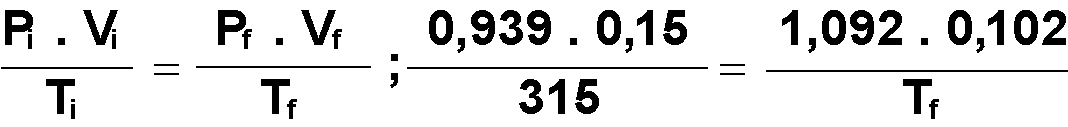 de donde:
de donde: 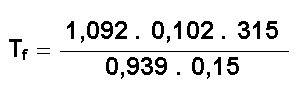 ;
T f = 249,1ºK = - 23,9ºC
;
T f = 249,1ºK = - 23,9ºC
3- Se tienen 64 gramos de oxígeno (O2) en condiciones normales de presión y temperatura. Calcular el volumen que
ocuparán a una presión de 900 mm Hg y una temperatura de 37ºC.
SOLUCIÓN
Para aplicar la ecuación general de los gases ideales, hemos de calcular antes el volumen que ocupa la
cantidad de Oxígeno que tenemos. Para ello, hemos de recordar el Volumen Molar Normal: "Un mol de cualquier
gas en Condiciones Normales de Presión y Temperatura ocupa 22,4 litros". En este caso, el número de moles que
tenemos, sabiendo que el peso molecular del O2 es: 2 . 16 = 32 g/mol, es: 
por lo que el volumen que ocupan estos dos moles en condiciones normales es:
2 moles.22,4 litros/mol = 44,8 litros y por tanto las condiciones iniciales y finales de esta cantidad de gas serán:
|
CONDICIONES INICIALES |
CONDICIONES FINALES |
| Presión: Pi = 1 atm
Volumen: V i = 2 moles . 22,4
l/mol = 44,8 litros
Temperatura: Ti =
0ºC = 273 ºK
|
P f =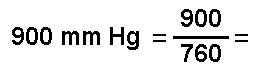 1,184 atm 1,184 atm
V f = ? Litros
Tf = 37 + 273 = 310 ºK |
Y ahora , se le aplica la ecuación general de los gases ideales, y nos quedará:
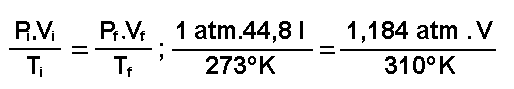 de donde:
de donde:  ;
V f = 42,97 litros
;
V f = 42,97 litros
PROBLEMAS DE APLICACIÓN DE LAS LEYES GENERALES DE LOS GASES.
- Un recipiente contiene 152 ml de argón a 10 mm de Hg y 20C. ¿Qué volumen ocupará en
C.N.?
- ¿A qué temperatura deben enfriarse 600 ml de hidrógeno para que ocupen 275 ml si no ha variado la presión y
la temperatura inicial era de 125C? (Sol: 182,4K)
- ¿ Qué volumen ocuparan 10 g. de Oxígeno a 2 atm. y 50C? (Sol: 4,14 l)
- Un gas ocupa un volumen de 100 litros a 200C y 1 atm. ¿A qué presión mínima debe someterse isotérmica-mente para que ocupe 1 l.? (Sol: 100
atm)
- En un recipiente vacío de 10 litros de capacidad se introducen 1,8 g de agua y 8,6 g de hexano y se calienta a
227C, con lo que el hexano se vaporiza. Calcular las presiones parciales y la presión total a esa temperatura.
¿Cuantas moles y moléculas habrá de cada componente en dicho recipiente?
- Un recipiente de 3 l. lo llenamos de Oxígeno a 10C y 740 mm de presión ¿Cuantos gramos hemos Introduci-do? ¿Cuantos moles? ¿Cuál debería ser la temperatura para que la presión se redujera a la mitad?¿Cuál es la
densidad? (Sol: 4,03g = 0,12 moles; T = -131,5ºC ; d = 1,34 g/l)
- En un recipiente vacío de 10 litros se colocan 0,35 moles de Hidrógeno, 21 g. de Nitrógeno y 229 4 l. de anhídri-do carbónico medidos en C. N.. Si lo ponemos a 25C, determinar la presión total y las presiones parciales de
los gases. (Sol: N: 1,831 atm; H: 0,857 atm; CO2 : 2,442
atm)
- Una muestra de un gas desconocido que pesa 2,46 g. ocupa 820 ml a 35C y 800 Torr. (1 Torr = 1 mm Hg) ¿Cual es su peso molecular? (Sol: 71,98)
- Una cierta cantidad de gas está contenida en un recipiente a -10C y 750 mm. de presión. Si el gas se calienta a
35C ¿Cual será la nueva presión si no varía el volumen ? ¿ Cual sería esta presión si el volumen aumentara un
2 %? (Sol: a) 1,15 atm; b) 1,13
atm)
- 214 mg. de un elemento gaseoso constituido por moléculas biatómicas a 20C y 1,6 atm. de presión ocupan un
volumen de 100 ml. ¿ Qué elemento es y cual es su densidad en condiciones normales?
(Sol: Pm=32,13=> Oxígeno; d= 1,435 g/l)
- Una mezcla de gases a 1 atm. de presión contiene un 65,0% de Nitrógeno a 10,0% de Oxígeno y 25,0% de anhidrido carbónico en volumen.- Calcular la presión parcial de cada gas en la mezcla.
(Sol: N: 0,65 atm; O: 0,10 atm; CO2 : 0,25
atm)
- En una mezcla de tres gases A, B y C, las fracciones molares de B y C son, respectivamente el doble y el triple
que la de A. - Calcúlense las presiones parciales que ejercen cada uno de ellos si la presión total es de 760 mm
Hg (Sol: A: 126,67 mm Hg; B: 253,3 mm Hg; C: 380 mm
Hg)
- 12 g. de lodo sólido, de densidad 4,66 g/mi. se colocan en un matraz de 1 litro. El. matraz se llena entonces con
N2 a 20C y 750 mm. de presión y se cierra.- Se calienta a 200C con lo que se vaporiza el yodo. ¿Cual será
entonces la presión total? ¿Y las presiones parciales (Sol: P total: 3,42 atm ; Pyodo= 1,82 atm; PNitrógeno= 1,59
atm)
- Un recipiente abierto en comunicación con el aire se calienta de 18C a 200C. Hallar la fracción del aire
contenido en el recipiente que será expulsado. (Sol: Sale el 62%)
- Se tienen dos recipientes de 10 y 20 litros. El primero contiene Nitrógeno a 187 mm. y 25C y el segundo
contiene Neón a 935 mm y 25C. Calcular: a) peso de gas que hay en cada recipiente; b) Presión del conjunto si
se comunican ambos recipientes; c) Peso de Nitrógeno y Neón en cada recipiente inmediatamente después de
conectarse entre sí. (Sol: a) 2,82 g de N2 y 20,14 g de Ne; b) 0,90 atm; c) en el A: 2,82 g de N2 y 5,41 g
de Ne y en el B: 14,82 g de Ne solamente)
- 50 litros de aire seco a 25C y 700 mm. de presión se hacen burbujear lentamente a través de agua. El aire
saturado de vapor de agua sale a 20C y 1 atm. Calcular. a) Volumen final de la mezcla;
b) gramos de agua
evaporados; c) sí la mezcla se comprime a 20C hasta 5 atm., determinar la cantidad de agua que se condensa.
- P. vapor de agua a 20C: 17, 5 mm de Hg. (Sol: a) 46,23 litros; b) 0,80 g de agua; c) 0,64 g de agua
condensada.) RESOLUCIÓN

- Se recogen 55 ml. de Hidrógeno sobre agua a 25C y 750 mm. de Hg. - Si el gas estuviese seco y en
condiciones normales ¿ qué volumen ocuparía ? Presión de vapor del agua a 25C: 23,8 mm. de Hg. (Sol: 0,048 litros)
- ¿Qué volumen ocuparán, recogidos sobre agua a 40C y 780 mm de presión, 453,0 ml. de nitrógeno seco recogidos inicialmente a 20C y 700 mm.? P. vapor del agua a 40C = 55,3 mm. de Hg. (Sol: 0,467 litros)
- Se tiene una corriente de gas formada por una mezcla de metano (CH4) y propano (C3H8) y queremos conocer
las presiones relativas de los dos gases por lo que quemamos la mezcla en un exceso de Oxígeno y recogemos
dióxido de carbono y agua.- ¿Cual es la relación entre las presiones si encontramos 1,09 g. de
dióxido de carbono por cada 0,606 g. de agua? (Sol: P propano/P metano =
8,04) RESOLUCIÓN

- 10 moles de metano ocupan 1756 ml. a 0C y 100
atm. Calcular la presión median te: a) Ecuación de los gases
ideales; b) Ecuación de Van der Waals; a=2,25 l2.atm/mol ; b= O,0428
l/mol. Comparar los resultados de
ambas ecuaciones. - (Sol: a) 127,48 atm y b) 95,60
atm)
- 0,350 gramos de una sustancia volátil se vaporizan en un aparato de Victor
Meyer. El aire desplazado ocupa
65,8 ml medido sobre agua a 40C y 748 mm de Hg. ¿Cual es el peso molecular de dicha sustancia? DATO:
Presión de vapor del agua a 40C = 55,3 mm de Hg
- Utilizando la ecuación de Van der Waals para los gases reales, calcular la presión que ejercerían 5,8 g. de butano a 27C en un recipiente de 100 cm3; b= 0,121
l/mol ; a= 1,432 atm.l2/mol2 (Sol: 26,55
atm)
- En un recipiente de 10 litros se introducen 12,4 g de etanol y 18,7 gramos de
acetona (propanona) . Después de
cerrar el recipiente se calienta hasta 300ºC, temperatura que está muy por encima de los puntos de ebullición de
ambos líquidos. Calcular las presiones parciales de cada gas así como la presión total en el interior del
recipiente, suponiendo un comportamiento ideal de ambos gases (Sol: P1 = 1,27 atm ; P2 =
1,50 atm ; Ptotal = 2,77 atm)
- La concentración de monóxido de carbono, que es un gas venenoso, en el humo de un cigarrillo es de 20.000
p.p.m (partes por millón) en volumen. Calcular el volumen de este gas que hay en 1 litro del humo procedente
de la combustión de un cigarrillo.(Sol: 20 cm 3 )
- En una medida del metabolismo basal, un paciente exhaló en seis minutos 52,5 litros de aire, medidos sobre
agua a 20ºC. La presión de vapor del agua a 20ºC es de 17,5 mm Hg, y la presión barométrica era 750 mm Hg.
El análisis de ese aire dió un 16,75% de oxígeno en el volumen de aire exhalado y un 20,32% en el inhalado.
Calcular el consumo de oxígeno del paciente por minuto, medido en ml y en C.N. (Sol: 280
ml/min)
- El volumen que corresponde a una inspiración de aire en una persona normal es, aproximadamente, 0,5 litros y
el número de inspiraciones por minuto es de unas 18. Si las condiciones atmosféricas son 20ºC y 745 mm Hg,
Determinar cuantos gramos de oxígeno aspira por minuto una persona (Sol: 2,46 gramos)

 0,947 atm
0,947 atm
 0,947 atm
0,947 atm
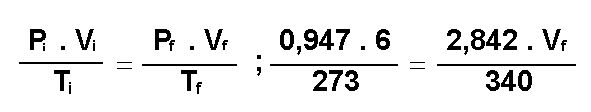 de donde:
de donde:  ;
V f = 2,490 litros
;
V f = 2,490 litros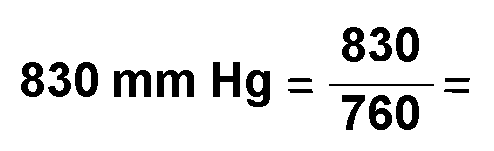 1,092 atm
1,092 atm
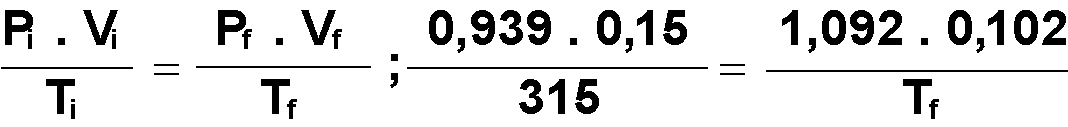 de donde:
de donde: 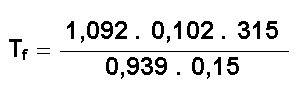 ;
T f = 249,1ºK = - 23,9ºC
;
T f = 249,1ºK = - 23,9ºC 
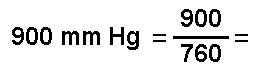 1,184 atm
1,184 atm
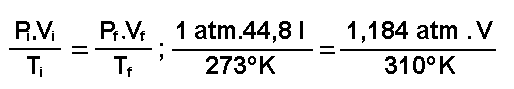 de donde:
de donde:  ;
V f = 42,97 litros
;
V f = 42,97 litros